
L’exercici físic s’ha convertit gradualment en un focus en el tractament del càncer a causa del seu paper pronunciat en la reducció del risc de càncer, la millora de l’eficàcia terapèutica i la millora del pronòstic. En les últimes dècades, els músculs esquelètics s’han considerat òrgans endocrins, exercint les seves funcions biològiques a través dels sistemes endocrí, autocrí i paracrí secretant diversos tipus de mioquines. La quantitat de mioquines secretades varia segons la intensitat, el tipus i la durada de l’exercici. Estudis recents han demostrat que les mioquines derivades dels músculs estan molt implicades en els efectes de l’exercici sobre el càncer. Múltiples mioquines, com la interleucina-6 (IL-6), l’oncostatina M (OSM), la proteïna secretada àcida i rica en cisteïna (SPARC) i l’irisina, intervenen directament en la progressió del càncer influint en la proliferació, l’apoptosi, la resistència als fàrmacs, la reprogramació metabòlica i la transformació epiteli-mesènquima (EMT) de les cèl·lules canceroses. A més, la IL-6, la interleucina-8 (IL-8), la interleucina-15 (IL-15), el factor neurotròfic derivat del cervell (BDNF) i l’irisina poden millorar la inflamació induïda per l’obesitat estimulant la lipòlisi dels teixits adiposos, promovent la captació de glucosa i accelerant l’enfosquiment del greix blanc. A més, algunes mioquines podrien regular el microambient tumoral, com l’angiogènesi i el microambient immunitari. La caquèxia cancerosa es produeix en fins al 80% dels pacients amb càncer i és responsable del 22%-30% de les morts dels pacients. Es caracteritza per inflamació sistèmica i disminució de la massa muscular. La producció de mioquina induïda per l’exercici és important ja que pot contribuir a regular la caquèxia cancerosa i per inhibir la progressió del càncer.
PAPER DE L’EXERCICI EN ELS CÀNCERS RELACIONATS AMB L’OBESITAT
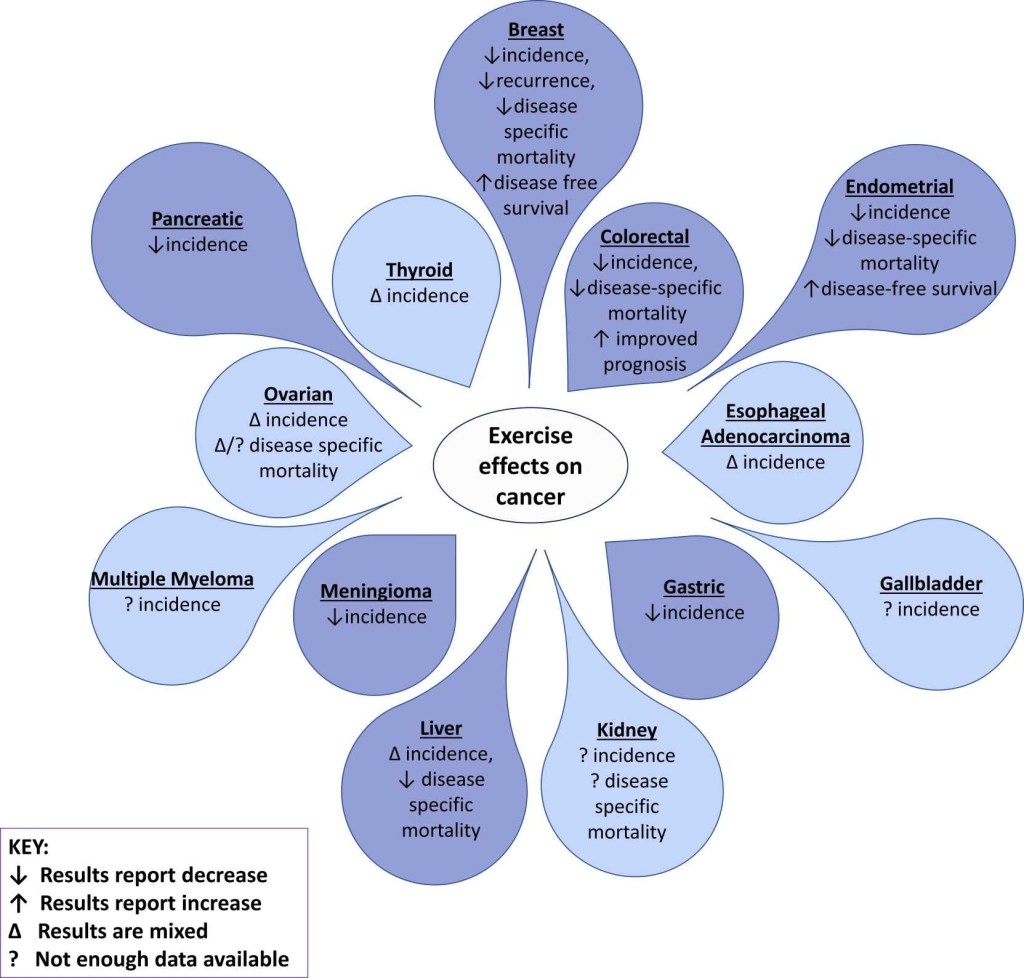
El càncer se situa com una de les cinc principals causes de mort a gairebé tots els països, i constitueix la segona causa de mort a nivell mundial. Gairebé 20 milions de nous casos de càncer i 10 milions de morts relacionades amb el càncer ocorren anualment a tot el món. Entre els tipus de càncer més prevalents, el càncer de mama representa el 12% de tots els casos nous de càncer, el càncer de pulmó l’11%, el càncer de pròstata el 7% i el càncer no melanoma de pell i còlon aproximadament 6% cadascun.
Certes comorbiditats, com l’obesitat, augmenten la probabilitat d’incidència de càncer. L’obesitat s’ha associat amb majors taxes d’almenys 13 càncers, incloent càncer d’endometri, adenocarcinoma d’esòfag, càncer gàstric, càncer de fetge i ronyó, entre d’altres. Prevenir l’aparició de càncer i millorar els resultats del càncer equival a alleujar la càrrega dels pacients i els sistemes de salut. L’activitat física, que és important en el maneig de l’estil de vida de l’obesitat, és una d’aquestes estratègies. En manipular alguns dels factors de risc per al càncer, inclosa l’adipositat corporal, els nivells d’hormones sexuals, la sensibilitat a la insulina, l’equilibri entre les citocines proinflamatòries i antiinflamatòries (incloses les adipocines i les miocines) i la resposta immune, l’exercici regular pot produir efectes beneficiosos tant a la incidència com a la supervivència del càncer.
Millora de la resistència a la insulina i atenuació de la hiperinsulinèmia
Cada cop hi ha més proves que el metabolisme de la glucosa resistent a la insulina està etiològicament relacionat amb la tumorigènesi i s’associa amb diagnòstics clínics de càncer. En un estat de resistència a la insulina, l’absorció de glucosa als teixits sensibles a la insulina (predominantment múscul esquelètic) disminueix. Per tant, el cos requereix una quantitat d’insulina més gran del normal per mantenir la concentració de glucosa a la sang i evitar la hiperglucèmia, que s’aconsegueix mitjançant la secreció compensatòria d’insulina del pàncrees, fet que porta a diversos graus d’hiperinsulinemia. Les persones amb obesitat sovint tenen resistència a la insulina i hiperinsulinèmia, juntament amb nivells elevats d’àcids grassos lliures circulants (AGL) que poden augmentar encara més la secreció d’insulina de les cèl·lules β pancreàtiques .
L’activitat física pot ajudar a mitigar la resistència a la insulina i, per tant, alleujar la hiperinsulinemia i, per tant, possiblement també l’augment resultant del risc de càncer. De fet, l’exercici de resistència i potser també l’exercici de força augmenta agudament la sensibilitat a la insulina durant 2-3 dies. En general, es creu que l’augment de la sensibilitat a la insulina i l’absorció de glucosa durant el període posterior a l’exercici està relacionat amb la necessitat de reposar les reserves de glucogen del múscul esquelètic que s’han esgotat amb l’exercici previ. Aquest efecte agut de sensibilització a la insulina de l’exercici pot ser exagerat amb episodis repetits d’exercici (és a dir, entrenament crònic), predominantment com a resultat de canvis a la composició corporal i particularment un augment en la massa muscular esquelètica. El múscul és responsable d’aproximadament el 20% de l’absorció de glucosa de tot el cos durant les condicions postabsortives i al voltant del 70 al 90% en condicions postprandials. Per tant, els augments induïts per l’exercici a la massa muscular poden augmentar l’absorció de glucosa a tot el cos i disminuir les concentracions de glucosa plasmàtica, cosa que alhora pot disminuir la necessitat de més insulina. En conseqüència, els efectes de l’activitat física en la prevenció i el pronòstic dels càncers relacionats amb l’obesitat poden estar intervinguts en part per la pèrdua de pes induïda per l’exercici.
Resolució de la inflamació
La inflamació ha estat relacionada amb la cascada d’esdeveniments involucrats en el desenvolupament i la progressió del càncer. Els nivells elevats de marcadors inflamatoris, com la proteïna C reactiva, la interleucina-6, el factor de necrosi tumoral alfa i la proteïna quimioatrayent de monòcits-1, estan fortament relacionats amb els diagnòstics de càncer. Aquestes citocines proinflamatòries també estan elevades en individus amb excés de pes i greix corporal i poden contribuir a l’evolució de càncers relacionats amb l’obesitat. La inflamació s’associa amb la reparació normal del teixit després d’una lesió, però també es pot tornar crònica, com és el cas de moltes malalties autoimmunes i amb l’obesitat. Com a promotor, la inflamació crònica pot contribuir a la neovascularització dels tumors i contribuir al ràpid creixement tumoral. L’exercici juntament amb la pèrdua de pes induïda per la dieta té un impacte beneficiós als biomarcadors inflamatoris associats amb el càncer. Els estudis han demostrat consistentment que l’activitat física regular redueix les citocines proinflamatòries.
Millora de la funció immunitària
La disfunció immunitària sistèmica és una altra característica del càncer, cosa que resulta en un risc més gran de càncer i un risc d’infecció més gran en les persones diagnosticades. Aquells amb sistemes immunes deteriorats, com és el cas dels receptors de donació d’òrgans i aquells amb malalties com el virus d’immunodeficiència humana / síndrome d’immunodeficiència adquirida (VIH/SIDA), tenen un risc de càncer més gran probablement a causa de la immunovigilància suprimida que altrament identificaria, atacaria i eliminaria el teixit danyat. A més, el càncer en si mateix s’associa amb una funció immune alterada. Entre altres tàctiques, el càncer pot aturar la producció de macròfags associats a la medul·la òssia i de neutròfils, creant un microambient tumoral que propaga encara més el creixement tumoral i afavoreix la metàstasi. L’obesitat també s’associa amb una funció immune deteriorada.
Per tant, veiem com treballant sobre els factors de risc per al càncer, com són l’adipositat corporal, els nivells d’hormones sexuals, la sensibilitat a la insulina, l’equilibri entre les citocines proinflamatòries i antiinflamatòries i la resposta immune, l’exercici pot produir efectes beneficiosos tant a la incidència com a la supervivència del càncer.

